
《中國藥品標準》雜志 第21卷 第3期
作者:蘭奮 洪小栩 宋宗華 張偉
摘要:2020年版《中國藥典》是新中國成立以來的第十一版藥典,將于2020年12月1日正式實施。本文對2020年版藥典的整體情況進行了概要介紹。新版藥典在品種收載、貫徹藥品全生命周期管理理念、完善藥品標準體系、加強藥品安全性有效性控制、擴大成熟分析檢測技術的應用、加強與國際藥品標準協調等方面均取得了新的進展。新版藥典的實施將對整體提升我國藥品標準水平,提高藥品質量,保證公眾用藥安全有效,促進醫藥產業高質量發展發揮重要作用。
關鍵詞:中國藥典,藥品標準,質量控制
Overview of the Chinese Pharmacopoeia 2020 Edition
Lan Fen, Hong Xiao-xu, Song Zong-hua, Zhang Wei
Chinese Pharmacopoeia Commission
Abstract:The Chinese Pharmacopoeia (ChP) 2020 edition,which is the 11th edition since the first edition ChP was issued in 1953, willbe put into implementation on December 1, 2020. This papar gives a briefintroduction on the development of the ChP 2020 edition. It is made greatachievements for the ChP 2020 edition on increasing the number of monographincluded,carrying out the idea of the drug life cycle management,Improving thenational drug standards system, ,improving requirements on drug safety andefficacy,adopting more mature analytical techniques as well as strengtheningthe international drug standards harmonization. It will play important role forthe new edition ChP implementation to improve the level of the National DrugStandards, assure the drug quality and guarantee the public drug-use safety andput forward the high quality development for the pharmaceutical industry inChina.
Key words: Chinese Pharmacopoeia, Drug standards, Quality control
《中華人民共和國藥品管理法》(2019年修訂)中規定,國務院藥品監督管理部門頒布的《中華人民共和國藥典》(以下簡稱“《中國藥典》”)和藥品標準為國家藥品標準。國家藥品標準是國家為保證藥品質量,對藥品的質量指標、檢驗方法等作出的強制性技術規定。《中國藥典》是國家藥品標準體系的核心,是藥品生產經營者的基本遵循,是藥品監督管理工作的準繩。
1953年,我國頒布第一版《中國藥典》,新頒布的2020年版《中國藥典》(以下簡稱“2020年版藥典”)將于2020年12月1日正式實施,是迄今頒布的第十一版藥典。新版藥典的頒布實施將對我國藥品研發、生產、檢驗、流通以及監督管理將產生重大影響。現將2020年版藥典的基本情況概述如下:
1、新版藥典的整體情況
2020年版藥典編制工作責任重大、使命光榮。編制期間,國家藥典委員會各專業委員會和常設機構不忘初心、牢記使命、開拓創新、積極進取,深入學習貫徹習近平總書記關于藥品監管工作的系列重要指示批示精神,以“四個最嚴”的要求為指導,堅持以人民為中心的發展理念,貫徹落實新修訂的《藥品管理法》和《疫苗管理法》的有關規定,扎實推進新版藥典編制各項工作,切實保障制定和修訂的藥品標準科學、嚴謹、管用和有效。
2020年版藥典編制工作基本達到了編制大綱設立的各項既定目標。一是收載品種適度增加,總數達到5911種,進一步穩步提高藥典收載品種數量。二是基本完成國家藥品標準清理工作,其中涉及化學藥6263個品種、中成藥9585個品種、飲片藥材1252個品種、中藥提取物9個品種、生物制品373個品種,為完善標準提高和淘汰機制奠定了基礎。三是以實施“兩法兩條例”為契機,全面完善了藥典標準體系,貫徹藥品質量全程管理的理念,提高了橫向覆蓋中藥、化學藥、生物制品、原料藥、藥用輔料、藥包材以及標準物質的質量控制技術要求,完善了縱向涵蓋藥典凡例、制劑通則、檢驗方法以及指導原則的制修訂,加強了涉及藥品研發、生產、質控、流通和使用等環節的通用技術要求體系的建設。四是強化了《中國藥典》的規范性,藥典各部之間更加協調統一。建立、完善了統一規范的藥品、藥用輔料和藥包材通用名稱命名原則,加強了通用技術要求與品種標準內容的統一。五是加強藥典通用技術要求,重點完善了藥品安全性和有效性的控制要求,實現了“中藥標準繼續主導國際標準制定,化學藥、藥用輔料標準基本達到或接近國際標準水平,生物制品標準緊跟科技發展前沿,與國際先進水平基本保持一致”的總目標。六是加強了藥典機構間的國際交流與合作,促進了與藥典的協調統一,擴大了《中國藥典》的國際影響力。
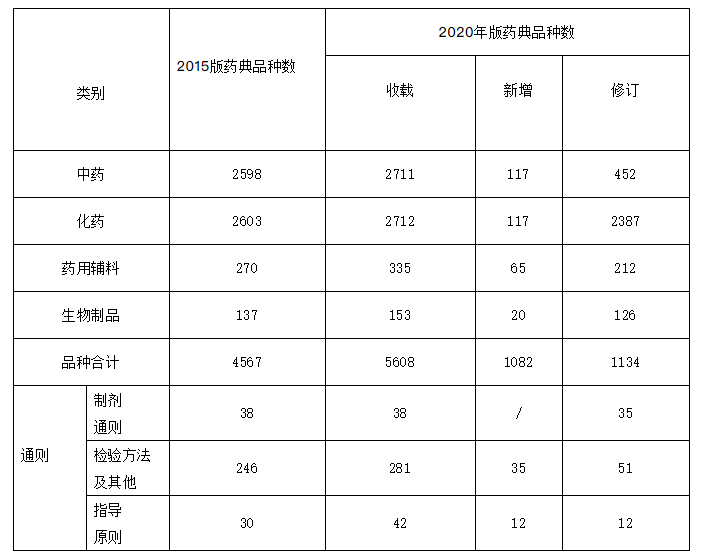
新版藥典新增319種,修訂3177種,不再收載10種,品種調整合并4種,共收載品種5911種。一部中藥收載2711種,其中新增117種、修訂452種。二部化學藥收載2712種,其中新增117種、修訂2387種。三部生物制品收載153種,其中新增20種、修訂126種;新增生物制品通則2個、總論4個。四部收載通用技術要求361個,其中制劑通則38個(修訂35個)、檢測方法及其他通則281個(新增35個、修訂51個)、指導原則42個(新增12個、修訂12個);藥用輔料收載335種,其中新增65種、修訂212種(見表1)。
表1 中國藥典2015年版與2020年版收載情況比較
2、新版藥典的主要特點
2.1穩步推進藥典品種收載
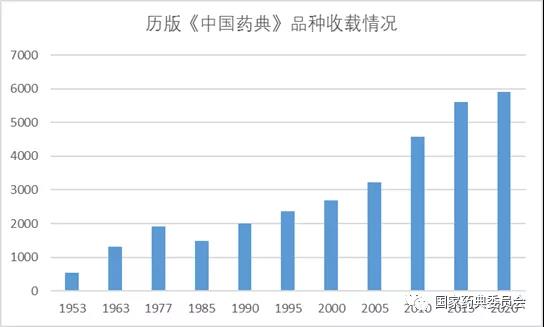
與2015年版藥典5608種相比,新版藥典收載品種增長5.5%。新版藥典品種收載堅持以臨床需求為導向,進一步擴大國家基本藥物目錄和國家基本醫療保險用藥目錄品種的收載,臨床常用藥品的質量得到進一步保障(見圖1)。及時收載生物藥康柏西普、脊髓灰質炎滅活疫苗等新上市品種,充分體現我國醫藥創新研發最新成果。
表2 1953-2020年版《中國藥典》收載品種數量情況圖片
2.2藥典標準體系進一步完善
2020年版藥典編制工作以建立科學、全面、可檢驗、能執行的標準體系為重點,構建并完善了以凡例為基本要求、通則為總體規定、指導原則為技術引導、品種正文為具體要求的藥典架構,不斷健全以《中國藥典》為核心的國家藥品標準體系。通過加強對藥典相關通用技術要求和正文具體內容的制修訂,整體提升我國藥品標準水平,推進我國上市藥品質量邁上新臺階。一是貫徹落實藥品全生命周期的監管理念,加強了藥品研發、生產、過程控制、質量控制、包裝、運輸、貯藏、有效性、穩定性考察等通用技術要求的制定,藥品質量控制由終端逐步向源頭和生產過程控制延伸,將風險控制點前移,全面保障藥品的質量。二是完善藥品檢驗方法學研究體系建設,建立并完善了分析方法驗證、方法轉移、方法確認以及生物檢驗統計等技術規范要求,為科學規范制定藥品標準夯實了基礎。三是結合各類藥品特性及質量控制關鍵點,進一步健全中藥、化學藥和生物藥涉及安全性和有效性的標準體系。四是加強了原料藥、藥用輔料以及藥包材等相關通用技術要求的制修訂,逐步形成以保障制劑質量為目標的原輔包標準體系,為推進關聯審評審批制度改革提供技術支撐。
2.3成熟分析檢測技術應用進一步擴大
新版藥典對標國際,緊跟國際前沿,借鑒國際先進標準經驗,不斷擴大成熟檢測技術在藥品質量控制中的應用,進一步提高檢測方法的靈敏度、專屬性、適用性和可靠性,對加強藥品質量控制,保障藥品質量,提升藥品監管能力發揮重要作用。建立分子生物學檢測標準體系,制定相關技術指導原則,新增聚合酶鏈式反應(PCR)法,DNA測序技術指導原則,為中藥材(飲片)、動物組織來源材料、生物制品起始材料以及微生物污染溯源鑒定的推廣應用奠定了基礎。新增檢測方法,強化質控手段。新增X射線熒光光譜法用于元素雜質控制;采用光阻法替代顯微法檢查乳粒粒徑;轉基因檢測技術應用于重組產品活性檢測,新增免疫化學法通則等。擴大成熟檢驗方法在藥品質量控制的應用,如采用液質聯用法用于中藥中多種真菌毒素的檢測,采用氣質聯用法對農藥多殘留進行定性鑒別,高效液相色譜法逐步替代薄層色譜法測定化學藥有關物質,高效液相色譜法用于抗毒素分子大小分布檢測等。
2.4藥品安全性控制要求不斷加強
在中藥方面:加強對中藥材(飲片)33種禁用農殘的控制。加強對中藥材(飲片)真菌毒素的控制,在控制黃曲霉毒素基礎上,增訂了對人體危害較大的展青霉素、赭曲霉毒素A、玉米赤霉烯酮、嘔吐毒素等毒素控制。完善了《中藥有害殘留物限量制定指導原則》,指導合理制定中藥材(飲片)重金屬、農殘、真菌毒素等有害物質限度標準。加強中藥內源性毒性成分藥材的質量控制,不再收載含馬兜鈴酸類品種馬兜鈴、天仙藤標準,制定“九味羌活”丸中馬兜鈴酸I的限量標準。
在化學藥方面:加強藥品雜質控制,150個品種增修訂有關物質檢查項目及限度,明確90多種雜質結構及相關信息;對可能引入基因毒性雜質部分產品,如磺酸鹽類和沙坦類藥物,在生產要求項目項下增訂工藝的評估要求。重點加強高風險制劑涉及安全性控制項目的要求,如注射劑及眼用制劑中抑菌劑、抗氧劑,注射劑中非水溶劑,靜脈輸液及滴眼液的滲透壓控制等。修訂并規范了相關品種無菌和微生物限度要求。
在生物制品方面:加強了對病毒安全性控制,原料血漿增訂病毒核酸標志物檢測,增訂生物制品病毒安全控制通則。新增氫氧化鋁佐劑質量控制通則,提升了疫苗佐劑質量。明確了原液合批、防腐劑及抗生素使用的相關原則;增訂重組生物技術產品相關蛋白雜質的控制和限度。
2.5藥品有效性控制不斷完善
在中藥方面:建立了顯微檢查法、薄層色譜法、高效液相色譜法、聚合酶鏈式反應(PCR)法以及核酸序列檢測法等一系列中藥材(飲片)鑒別方法,提高了方法的專屬性。基于研究建立了與臨床療效相關的成分含量控制,如丹參中的丹酚酸B和葛根中的葛根素的含量測定方法。以質量為標的,制定成分限量標準,加強質量可控性,如針對青翹和老翹的相同指標分別制定不同限度標準。建立專屬性高的指標成分控制項目,體現中藥炮制“生熟異治”傳統特色,如熟地黃飲片增加地黃苷D的含量測定指標。
在化學藥方面:完善藥品制劑的有效性指標項目,針對不同劑型特點,增訂相應控制項目,如克霉唑陰道膨脹栓增加了膨脹值檢查;鋁碳酸鎂咀嚼片修訂了制酸力測定法。進一步完善口服固體制劑溶出度檢測方法,83個品種新增或修訂了溶出度項目。加強與放射性藥品活性相關的檢查方法的研究和增訂,部分品種增加了放射性核純度檢查。
在生物制品方面:增訂了人用聚乙二醇化重組蛋白及多肽制品、螨變應原制品和人用基因治療制品總論等,重組類治療生物制品增訂了相關蛋白檢測及限度要求等。
2.6全過程質量控制體系逐步構建
進一步加強了涉及藥品研發、生產、檢測、運輸、包裝、貯藏等可能影響藥品質量環節的相關指導原則的制定,逐步構建全過程質量控制體系。完善了滅菌工藝驗證、環境檢測等相關技術要求,修訂了非無菌藥品微生物限度標準、藥品潔凈實驗室微生物監測和控制指導原則、無菌檢查用隔離系統驗證指導原則、藥品微生物實驗室質量管理指導原則。
通過對注射劑生產過程中無菌保障體系的評估與調查,增訂了滅菌用生物指示劑指導原則、生物指示劑耐受性檢查法指導原則,并系統修訂了滅菌法,明確企業對控制生產過程中的微生物污染承擔主體責任。對制劑通則整體框架進行較系統的增修訂,為控制和保證制劑生產的“批內差異性和批間一致性”,特別明確了“單位劑量均勻性”要求,以體現制劑全過程控制的理念;提出了“復檢期”概念,引導藥品生產企業根據產品自身穩定性進行前瞻性的質量考察;對“生產與貯藏期間應符合下列規定”的體例及內容進行了統一,即按照:原輔料→工藝與技術→質量與控制→包裝與使用→貯存與運輸等五個方面的技術要點做出規范,對相關劑型增訂了工藝控制技術要求。
2.7輔料標準水平進一步提升
進一步增加制劑生產常用藥用輔料標準的收載,與2015年版收載270個藥用輔料標準相比增長19.4%。貫徹原輔包關聯審評審批制度質量控制理念,不斷健全藥用輔料國家標準體系,加強藥用輔料自身安全性控制,基于輔料雜質或自身降解產物可能對制劑安全性和穩定性產生的影響,建立相應的控制項目和限度標準,完善輔料相關功能性控制項目的設了、評價方法的建立以及限度標準的制定。整體提升藥用輔料的控制要求,進一步保證制劑質量。
2.8國際標準協調進一步加強
加強與國外藥典的比對研究,注重國際成熟技術標準的借鑒和轉化,不斷推進與各國藥典標準的協調。參考人用藥品注冊技術要求國際協調會(ICH)相關指導原則,新增遺傳毒性雜質控制指導原則,修訂原料藥物與制劑穩定性試驗、分析方法驗證、藥品雜質分析等指導原則,新增溶出度測定流池法、堆密度和振實密度測定法,修訂殘留溶劑測定法等,逐步推進ICH相關指導原則在《中國藥典》的轉化實施。
2.9藥典導向作用進一步強化
緊跟國際藥品標準發展的趨勢,兼顧我國藥品生產的實際狀況,在藥品監管理念、質量控制要求、檢測技術應用、工藝過程控制、產品研發指導等方面不斷加強。在檢測項目和限度標準設置方面,既考慮保障藥品安全的底線,又充分關注臨床用藥的可及性,進一步強化藥典對藥品質量控制的導向作用。
3、結語與展望
《中國藥典》2020年版的編制,正值我國“國民經濟和社會發展第十三個五年規劃綱要”實施期間,是實現全面建成小康社會的決勝階段,也是實施健康中國戰略,建立創新型國家、由制藥大國向制藥強國邁進的重要時期。新版藥典的問世,充分展現了我國科學技術和醫藥發展的成果,必將對提高上市藥品質量,保證公眾用藥安全有效,提升我國醫藥產業和產品的整體水平,促進我國醫藥衛生事業高質量發展發揮重要的作用。
文章內容來源:國家藥典委員會公眾號





