大腸桿菌感受態細胞的制備和質粒轉化
發布時間:2025-07-04 瀏覽次數:158
大腸桿菌宿主菌株作為受體細胞,當這些受體細胞經過(CaCl2)處理時,它們的細胞膜通透性會發生暫時性的改變,從而成為能夠允許外源DNA分子進入的感受態細胞。
一、感受態細胞
1.感受態:受體細胞最容易接受外源基因并將其轉化的一種生理狀態。
2.感受態細胞:受體細胞通過理化方法處理,使其處于最適攝取和容納外來DNA的生理狀態的細胞。
3.感受態菌齡:細胞的感受態一般出現在對數生長期,新鮮幼嫩的細胞是制備感受態和實現成功轉化的關鍵。
4.質粒轉化:質粒DNA或以他為載體構建的重組子導入細菌的過程。
二、感受態細胞制備的原理
1.外源基因表達的條件:重組質粒必須通過轉化進入細菌細胞內,才能進行擴增和表達,從而獲得大量的克隆基因。
2.感受態制備原理:將快速生長的大腸桿菌置于經低溫0℃預處理的低滲氯化鈣溶液中,便會造成細胞膨脹(滲透作用),同時,Ca2+會使細胞膜磷脂雙分子層形成液晶結構,促使細胞外膜與內膜間隙中的部分核酸酶解離開來,離開所在區域,誘導細胞成為感受態細胞。
3.質粒轉化原理:感受態細胞細胞膜通透性發生變化,極易與外源DNA相粘附并在細胞表面形成抗脫氧核糖核酸酶的羥基-磷酸鈣復合物。將該體系轉移到42℃下做短暫的熱刺激90s,細胞膜的液晶結構會發生劇烈擾動,并隨機出現許多間隙,外源DNA就可能被細胞吸收。
4.外源基因表達:進入細胞的外源DNA分子通過復制、表達,實現遺傳信息的轉移,使受體細胞出現新的遺傳性狀。將轉化后的細胞在選擇性培養基上(相應抗生素抗性)培養,篩選出帶有外源DNA分子的陽性克隆。
三、感受態細胞的制備(CaCl2法)
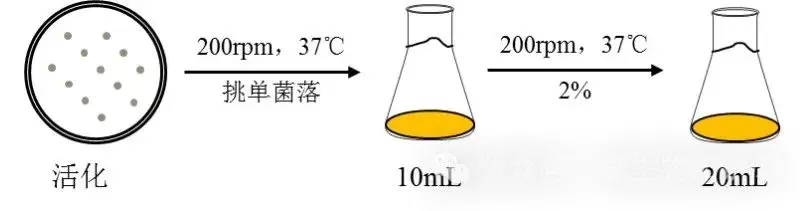
1. 受體菌種活化:取-80℃冰箱中保藏的菌株(如DH5α、Top10、DE3、BL21等)在LB平板(無抗性)上劃線分離,放置于37℃恒溫培養箱中倒置培養。
2. 受體菌培養:從LB平板上挑取單菌落,接種于10mL LB液體培養基中,37℃震蕩培養12h左右至對數生長中后期。
3. 菌種的準備:將受體菌菌懸液以2%的接種量接種于裝有20mL LB液體培養基(無抗性)中,37℃震蕩培養大約2-3h至OD600=0.4-0.5,菌落數<108cfu/mL。
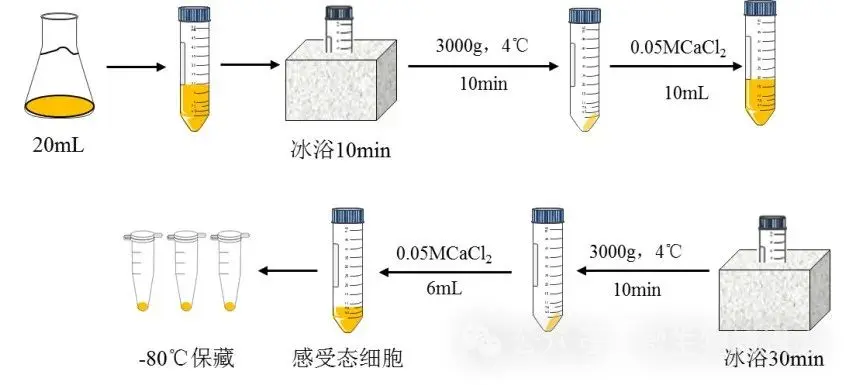
4. 感受態細胞的制備:
(1)離心:把上述菌液轉移至50mL離心管中,冰浴10min,在4℃,3000r/min,離心10min。
(2)重懸冰浴:棄上清液,加入10mL預冷的0.05M 的CaCl2溶液,輕輕混勻,冰浴30min后,在4℃,3000r/min,離心10min。
(3)重懸:棄上清,加入6mL預冷的含15%甘油的0.05MCaCl2溶液,輕輕混勻,冰上放置幾分鐘,即成感受態細胞懸液。或棄上清,加入6mL預冷0.05MCaCl2溶液,輕輕混勻,冰上放置幾分鐘,即成感受態細胞懸液,直接使用。
(4)分裝:用移液槍分裝重懸液至1.5mL離心管中,每個離心管中分裝50μL懸浮液。
(5)保藏:標記貼標簽,使之迅速冷凍,-80℃保藏備用。
五、質粒化學轉化
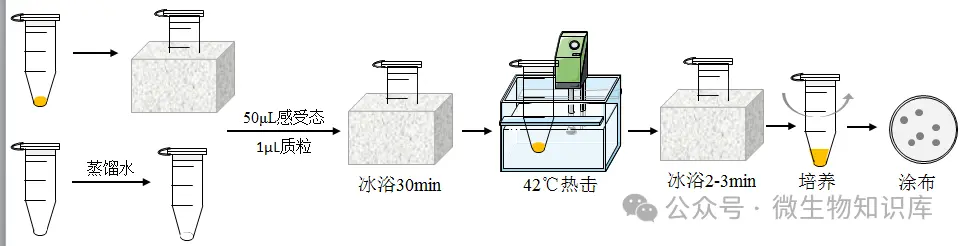
1.取感受態:如果感受態細胞保藏于-80℃,從-80℃冰箱中取一支感受態,室溫下解凍后立即冰浴;如果感受態細胞沒有保藏,可以直接用于轉化。
2.質粒處理:一般質粒為粉末,1ng質粒添加10μL緩沖液或蒸餾水,混勻。
3.轉化:在含有50μL感受態細胞的離心管中加入1μL稀釋后的標準質粒充分混勻,冰上靜置30min。
4.熱擊:將離心管置于42℃熱擊60-90s,然后迅速冰浴,使細胞冷卻2-3 min。
5.培養:向離心管中加入已預熱的無菌LB培養基(無抗性)300μL,150rpm、37℃恒溫震蕩培養45min。
6.涂布:吸取100μL菌液于LB固體培養基上(含抗性),用涂布器均勻涂布,放置于37℃恒溫培養箱中倒置培養12-16h。
7.轉化率計算:
轉化后在含抗生素的平板上長出的菌落即為轉化子,根據此皿中菌落數可計算出轉化子總數和轉化效率,公式如下:
轉化總數=菌落數×稀釋倍數×轉化反應原液總體積/涂板菌液體積
轉化率=轉化子總數/質粒DNA加入量μg
理論上轉化率最高為每微克的標準質粒轉化的菌落數為1×1010 。
六、注意事項
1. 嚴格無菌操作
操作過程,注意進行無菌操作,避免環境中雜菌污染。
2.嚴格控制溫度
操作過程,要注意操作溫度,以保持細胞的狀態;
加入抗生素時注意溫度,避免過高溫度導致抗生素失活。
3. 嚴格控制濃度
嚴格控制細胞的生長階段和菌濃,嚴格控制質粒DNA的質量和濃度,以提高轉化效率。
4. 計算轉化率
記錄和計算轉化率的指標如轉化子總數、感受態細胞總數和轉化頻率以評估轉化效率。
本文由環凱轉載自“微生物知識庫”GZH,版權歸原作者~所有,僅供學習參考,如有侵權請聯系刪除!








